Строение атома и его ядра
Согласно современным представлениям атом имеет сложное строение. В центре атома находится положительно заряженное ядро, вокруг которого вращаются частицы, имеющие отрицательный электрический заряд, называемые электронами (рис. 2).
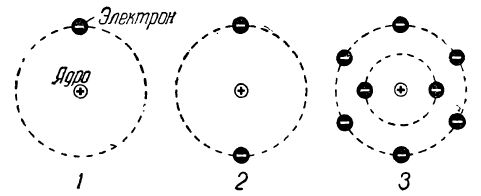
Рис. 2. Схема строения атомов: 1 — водорода, 2 — гелия, 3 — кислорода
Атом в целом в нормальных условиях является электрически нейтральным. Размеры атомов, а следовательно, и молекул, которые состоят из атомов, очень малы. Так, например, если бы вам удалось плотно уложить атомы водорода, то на отрезке длиной в 1 сантиметр, как показано на рис. 3, их поместилось бы 100 000 000.
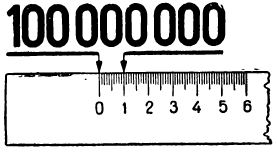
Рис. 3. На отрезке в 1 сантиметр можно уложить 100 000 000 атомов водорода
Советский физик Д. Д. Иваненко впервые указал на то, что ядро атома имеет сложное строение и, в свою очередь, состоит из протонов и нейтронов. Нейтроны и протоны вместе иногда называют нуклонами.
Протоны и нейтроны в ядре связаны особыми ядерными силами сцепления. Особенность этих сил заключается в том, что они действуют на очень малых расстояниях— в пределах ядра. За пределами ядра они равны нулю.
Протон - представляет собой элементарную частицу с положительным зарядом и ничтожно малой массы равной 0,000 000 000 000 000 000 000 001672 грамма.
Нейтрон — электрически незаряженная частица, масса которой почти равна массе протона и составляет 0,000 000 000 000 000 000 000 001674 грамма.
Схемы строения ядер атомов некоторых химических элементов приведены на рис. 4.
Из рисунка видно, что ядро атома простейшего химического элемента — водорода — состоит только из одного протона. Ядро атома гелия состоит уже из двух протонов и двух нейтронов.
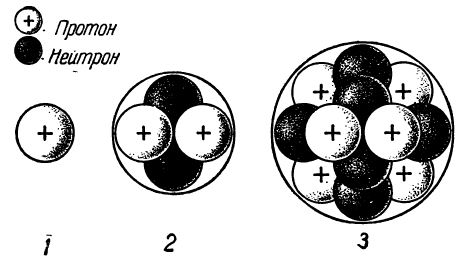
Рис. 4. Схемы строения ядер атомов: 1 — водорода, 2 — гелия, 3 — углерода
Какие же размеры ядра? Оказывается, что размеры ядра (его диаметр) примерно в 10 000 раз меньше размеров атома. Если представить себе ядро увеличенным до размера вишни, то величина атома будет соответствовать размерам здания высотой более 200 метров (рис. 5).

Наконец, электрон представляет собой отрицательно заряженную частицу, масса которого равна 0,000 000 000 000 000 000 000000 000 9106 грамма. Если сравнить массу электрона с массой протона, то мы увидим, что электрон значительно легче протона (примерно в 1840 раз). Как мы видим на рис. 6, весы уравновешены, если на чашах помещены соответственно один протон и 1840 электронов.
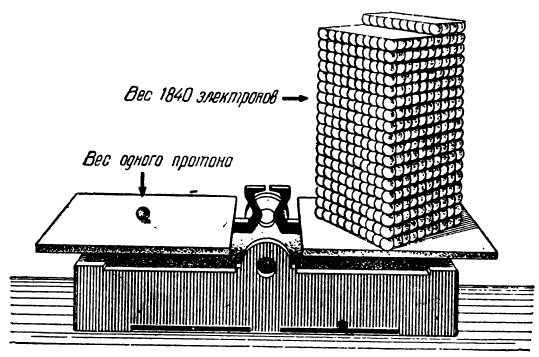
Рис. 6. Сравнение веса протона и электрона
Следовательно, если подытожить все вышесказанное, то отсюда следует, что почти вся масса атома сосредоточена в его ядре, ибо электроны ничтожно малы по весу. А если вспомнить, что размеры ядра очень малы и ядро в десятки тысяч раз меньше атома, то плотность атомных ядер должна быть очень велика. Действительно, если бы нам удалось плотно уложить, например, ядра атомов водорода в одном кубическом сантиметре, то вес такого кубика составлял бы 100 000 000 тонн.
Следовательно, масса ядра агома определяется общим количеством протонов и нейтронов, составляющих его.
Заряд же ядра определяется числом протонов, находящихся в нем. При нормальном состоянии атома число электронов, движущихся вокруг ядра, равно числу протонов в ядре.
В атомной физике приняты следующие единицы заряда и массы. В качестве единицы заряда принята абсолютная величина заряда электрона. Далее, так как масса атомов очень мала, то за единицу массы принимается 1/16 часть массы атома кислорода, называемая атомной единицей массы. В этой системе единиц масса протона равна 1,00757, нейтрона — 1,00894 и электрона—0,000549.
В периодической таблице элементов Д. И. Менделеева все химические элементы расположены в строгом порядке. Каждый химический элемент занимает вполне определенное место и имеет свой порядковый, или, как еще говорят, атомный, номер.
Величина же заряда ядра, которая определяется количеством протонов, выраженная в принятых нами элементарных единицах заряда, т. е. в электронах, равна порядковому номеру элемента в таблице Д. И. Менделеева.
Количество прртонов и нейтронов в ядре определяет его массу. Это общее количество протонов и нейтронов в ядре получило название массового числа ядра. Массовое число ядра — это атомный вес, выраженный с точностью до целых чисел.
В атомной физике ядра атомов всех химических элементов принято обозначать символами соответствующих химических элементов с двумя индексами — нижним и верхним, как показано на рис. 7. Нижний индекс — это заряд ядра, равный порядковому номеру элемента (равный числу протонов, входящих э ядро, или, что то же самое, числу электронов атома).
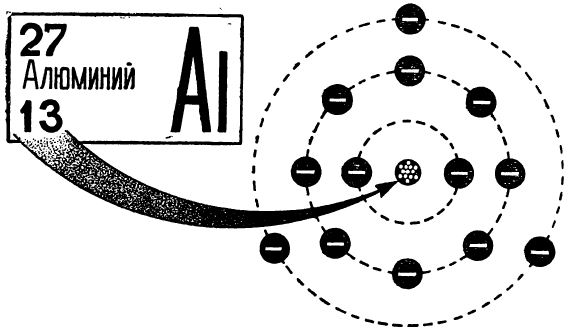
Верхний индекс — это массовое число, т. е. число протонов и нейтронов в ядре. Например, символ 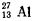 (или можно записать еще так 13люминий27) означает ядро атома алюминия с атомным номером 13 и массовым числом 27, т. е. ядро алюминия содержит 13 протонов
(или можно записать еще так 13люминий27) означает ядро атома алюминия с атомным номером 13 и массовым числом 27, т. е. ядро алюминия содержит 13 протонов
и 27—13= 14 нейтронов.
Большинство встречающихся в природе химических элементов представляет собой смесь двух и более разновидностей данного элемента. Ядра атомов этих элементов имеют одинаковое количество протонов, т. е. имеют одинаковый заряд, но различные массовые числа. Эти разновидности данного элемента получили название изотопов, что на русском языке означает «одноместные». Действительно, химические свойства элемента определяются количеством протонов в ядре атома, т. е. зарядом его ядра. А так как ядра изотопов имеют одинаковое число протонов, то они будут иметь[1] один порядковый номер, т. е. занимать одну клеточку в периодической системе элементов.
Но так как массовое число изотопов различное, то при одинаковом количестве протонов ядра атомов изотопов имеют различные количества нейтронов. Действительно, в природе известны, например, следующие изотопы урана:
- 92уран234
- 92уран235
- 92уран 238
Следовательно, в состав ядер этих изотопов входит одинаковое количество протонов равное 92, но разное количество нейтронов равное соответственно:
234 — 92=142
235 — 92 = 143
238 — 92= 146
В заключение данного раздела остановимся на так называемом процессе ионизации атомов.
Электроны, вращающиеся вокруг ядра атома, образуют так называемую электронную оболочку атома. Эта электронная оболочка состоит из нескольких слоев. Электроны атома при определенных условиях могут переходить с одного слоя на другой. Но этот переход возможен только при сообщении электрону извне дополнительной энергии. Если эта энергия достаточно велика, то электрон может вовсе покинуть пределы атома. В этом случае из электрически нейтрального атома образуется пара ионов[2].Этот процесс образования Электрически заряженных частиц из нейтрального атома носит название ионизации.
[1] Ионами называются частицы, имеющие электрический заряда
[2] Ионами называют частицы имеющие электрический заряд